Tofacitinib citrate is 'n voorskrifmedisyne (handelsnaam Xeljanz) wat oorspronklik deur Pfizer ontwikkel is vir 'n klas orale Janus kinase (JAK) inhibeerders. Dit kan JAK-kinase selektief inhibeer, JAK/STAT-weë blokkeer, en daardeur selseintransduksie en Verwante geenuitdrukking en aktivering inhibeer, wat gebruik word om rumatoïede artritis, psoriatiese artritis, ulseratiewe kolitis en ander immuunsiektes te behandel.
Die middel sluit drie dosisvorme in: tablette, tablette met volgehoue vrystelling en orale oplossings. Sy tablette is die eerste keer in 2012 deur die FDA goedgekeur, en die doseervorm met volgehoue vrystelling is in Februarie 2016 deur die FDA goedgekeur. Dit is die eerste om rumatoïede gewrigte te behandel. Yan is 'n JAK-inhibeerder wat een keer per dag mondelings geneem word. In Desember 2019 is 'n nuwe aanduiding vir middels met volgehoue vrystelling weer goedgekeur vir matige tot ernstige aktiewe ulseratiewe kolitis (UC). Daarbenewens is die huidige fase 3 kliniese proewe vir plaakpsoriase voltooi, en nog ses fase 3 kliniese proewe is aan die gang, wat aktiewe psoriatiese artritis, jeugdige idiopatiese artritis, ens. Soort indikasies behels. Die voordele van tablette met volgehoue vrystelling wat langwerkend is en net een keer per dag geneem moet word, is bevorderlik vir die bestuur en beheer van pasiënte se siektes.
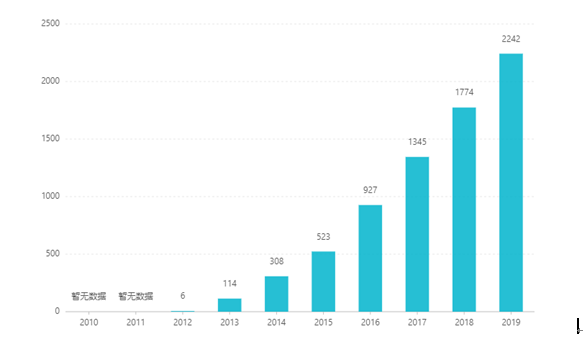
Sedert sy notering het sy verkope jaar na jaar toegeneem en bereik VS$2,242 miljard in 2019. In China is die tabletdoseervorm goedgekeur vir bemarking in Maart 2017, en het deur middel van onderhandelinge in 2019 die mediese versekering kategorie B-katalogus betree. bod is RMB 26,79. As gevolg van die hoë tegniese hindernisse van preparate met volgehoue vrystelling, is hierdie doseervorm egter nog nie in China bemark nie.
JAK kinase speel 'n belangrike rol in inflammasie, en die inhibeerders daarvan is getoon om sekere inflammatoriese en outo-immuun siektes te behandel. Tot nou toe is 7 JAK-remmers wêreldwyd goedgekeur, insluitend Leo Pharma se Delgocitinib, Celgene se Fedratinib, AbbVie se upatinib, Astellas se Pefitinib, Eli Lilly se Baritinib en Novartis se Rocotinib. Slegs tofacitinib, baritinib en rocotinib word egter in China onder die bogenoemde middels goedgekeur. Ons sien uit daarna dat Qilu se “Tofatib Citrate Tablette met volgehoue vrystelling” so gou moontlik goedgekeur word en meer pasiënte sal bevoordeel.
In China is die oorspronklike navorsing-tofacitib-sitraat in Maart 2017 deur die NMPA goedgekeur vir die behandeling van volwasse RA-pasiënte met onvoldoende doeltreffendheid of onverdraagsaamheid teenoor metotreksaat, onder die handelsnaam Shangjie. Volgens data van Meinenet was die verkope van tofacitib-sitraattablette in China se openbare mediese instellings in 2018 8,34 miljoen yuan, wat baie laer was as sy wêreldwye verkope. ’n Groot deel van die rede is die prys. Daar word berig dat Shangjie se aanvanklike kleinhandelprys 2085 yuan (5mg*28 tablette) was, en die maandelikse koste was 4170 yuan, wat nie 'n klein las vir gewone gesinne is nie.
Dit is egter die moeite werd om te vier dat tofacitib ingesluit is in die 2019 “Nasionale Basiese Mediese Versekering, Werkbeseringsversekering en Kraamversekering Dwelmlys” deur die Nasionale Mediese Versekeringsadministrasie ná onderhandelinge in November 2019. Daar word berig dat die maandelikse fooi verminder sal word tot onder 2000 yuan na die prysverlaging onderhandel is, wat die aansienlik sal verbeter beskikbaarheid van die dwelm.
In Augustus 2018 het die Patent-hereksamenraad van die Staatskantoor vir Intellektuele Eiendom 'n hersieningsbesluit No. 36902-versoek om ongeldigverklaring gemaak en die kernpatent van Pfizertofatib, die saamgestelde patent, ongeldig verklaar op grond van onvoldoende openbaarmaking van die spesifikasie. Die patent van Pfizertofatiib kristalvorm (ZL02823587.8, CN1325498C, aansoekdatum 2002.11.25) sal egter in 2022 verval.
Die Insight-databasis toon dat, bykomend tot die oorspronklike navorsing, vyf generiese middels van Chia Tai Tianqing, Qilu, Kelun, Yangtze-rivier en Nanjing Chia Tai Tianqing goedgekeur is vir bemarking in die huishoudelike tofacitinib-tabletformulerings. Vir die volgehoue-vrystelling tablet-tipe het egter net die oorspronklike navorsing Pfizer 'n bemarkingsaansoek op 26 Mei ingedien. Qilu is die eerste plaaslike maatskappy wat 'n bemarkingsaansoek vir hierdie formulering indien. Daarbenewens is CSPC Ouyi in die BE-proefstadium.
Changzhou Pharmaceutical Factory (CPF) is 'n toonaangewende farmaseutiese vervaardiger van API's, voltooide formulerings in China, wat in Changzhou, Jiangsu-provinsie geleë is. CPF is in 1949 gestig. Ons het vanaf 2013 in Tofacitinib Citrate toegewy, en reeds DMF ingedien. Ons het in baie lande geregistreer en kan jou ondersteun met die beste dokumente-ondersteuning vir Tofacitinib Citrate.
Postyd: 23 Julie 2021